Современные методы профилактики и лечения часто болеющих детей (ЧБД) остаются недостаточно эффективными, а единых подходов к иммунотерапии, которая иногда рассматривается как способ иммунокоррекции пациентов этой группы, в настоящее время нет1. В этой связи особенно актуальным может быть применение пробиотиков, в дополнение к основной терапии, в качестве средств, корректирующих иммунный ответ.
Часто болеющий ребенок: выбор пробиотиков для коррекции иммунитета
От теории — к практике
Термин «часто болеющие дети» появился в отечественной медицинской литературе в 80-х годах прошлого века. Он обозначил группу детей, выделяемую при диспансерном наблюдении, которая характеризуется более высоким по сравнению со сверстниками уровнем заболеваемости острыми респираторными вирусными инфекциями (ОРВИ). Возникает закономерный вопрос: сколько это — слишком много?
Максимальная заболеваемость ОРВИ в детской популяции отмечается в возрасте от 6 месяцев до 6 лет и составляет от 4 до 6 заболеваний в год. Среди школьников заболеваемость снижается до 2-5 случаев в год2. Повышенной уязвимостью перед респираторными вирусными инфекциями характеризуется организм ребенка от 6 месяцев до 6 лет, и это — не отклонение от нормы, а особенность возрастного периода. Однако чаще всего в группу диспансерного наблюдения ЧБД попадают пациенты на 2-м году жизни (таблица 1).
Таблица 1. Критерии включения детей в группу часто болеющих2| Возраст | Частота эпизодов ОРВИ в год |
| До 1 года | 4 и более |
| 1-3 года | 6 и более |
| 4-5 лет | 5 и более |
| Старше 5 лет | 4 и более |
Именно для детей 2-6 лет характерна высокая пролиферативная активность лимфоцитов с повышением содержания фракции недифференцированных, «наивных» лимфоцитов по сравнению с взрослыми. В этом возрасте также происходит переориентация иммунного ответа на инфекционные антигены с превалирования Th2-пути, свойственного новорожденным и детям первых месяцев жизни, на Th1-путь, типичный для инфекционного процесса у взрослых. Эти и некоторые другие возрастные особенности иммунной системы ребенка обусловливают более высокую чувствительность организма ребенка к инфекциям и менее дифференцированный по сравнению со взрослыми ответ иммунной системы в целом на воздействие инфекции2.
Исследования показали, что у ЧБД даже в период клинического благополучия и при отсутствии признаков ОРВИ выявляются изменения в межклеточном взаимодействии в иммунной системе2. Достоверно повышается содержание провоспалительных интерлейкинов (ИЛ) ИЛ-2 и ИЛ-4, в том числе участвующих в хронизации процессов воспаления (ИЛ-6, ИЛ-8).
Такое состояние иммунной системы становится фактором высокого риска развития осложнений как местных (присоединение бактериального воспаления на различных уровнях респираторного тракта), так и общих (формирование иммунокомплексной и другой иммунной патологии)2.
В основе медицинской помощи ЧБД — мероприятия, направленные на повышение резистентности организма ребенка в целом.
Основу для возможностей создания противоинфекционной защиты при ОРВИ заложили исследования последних лет, продемонстрировавшие связь иммунной системы и микробиоты кишечника3.
В фокусе – пробиотики
Пробиотики активно изучаются как модуляторы иммунной функции при вирусных инфекциях респираторного тракта. Напомним, пробиотики — это живые микроорганизмы, которые при употреблении в необходимом количестве оказывают благоприятное воздействие на здоровье организма-хозяина4. К ним прежде всего относятся бактерии, свойственные нормальной микрофлоре желудочно-кишечного тракта: различные виды лакто- и бифидобактерий3.
Традиционно используемые пробиотики не вызывают опасений при применении: их профиль безопасности подтверждается рядом исследований5-7.
Иммунологические аспекты воздействия пробиотиков хорошо изучены. Известно, что эпителиальные клетки ЖКТ находятся в контакте с микробиотой кишечника и взаимодействуют с клетками иммунной системы. Местные стимулирующие эффекты слизистой оболочки могут влиять на иммунные ответы в других тканях слизистой оболочки и способствовать противовирусному эффекту.
Прямое воздействие пробиотиков на иммунную функцию обусловлено взаимодействием бактериальных структур или их метаболитов со толл-подобными рецепторами на эпителиальных и иммунных клетках хозяина. С другой стороны, пробиотики могут косвенно влиять на иммунную функцию, изменяя состав и/или активность микробиоты хозяина8.
Изучено. Доказано. Внедрено в практику
Одним из самых изученных и апробированных пробиотических штаммов является Lactobacillus rhamnosus ATCC 53103 (Lactobacillus rhamnosus GG или LGG). Установлено, что LGG продуцирует антимикробные факторы, подавляющие активность таких микроорганизмов как Clostridium spp., Pseudomonas spp., Salmonella spp., Escherichia coli, Staphylococcus и Streptococcus spp.9 Даже термически обработанные LGG повышают продукцию иммунокомпетентными клетками ИЛ-4 и ИЛ-10, а также дозозависимо снижают продукцию фактора некроза опухоли-альфа, индуцируемую микробными полисахаридами9.
При этом штамм не конкурирует с другими симбионтами/комменсалами и не вытесняет другие лактобациллы, а также положительно влияет на адгезию бифидобактерий9.
Результаты двойного слепого рандомизированного плацебо-контролируемого исследования с участием 281 детей-воспитанников детских садов10 показали, что ежедневный прием LGG может значительно снизить частоту инфекций верхних дыхательных путей (рис. 1).
Рисунок 1. Динамика риска инфекций верхних дыхательных путей на фоне применения LGG и плацебо10
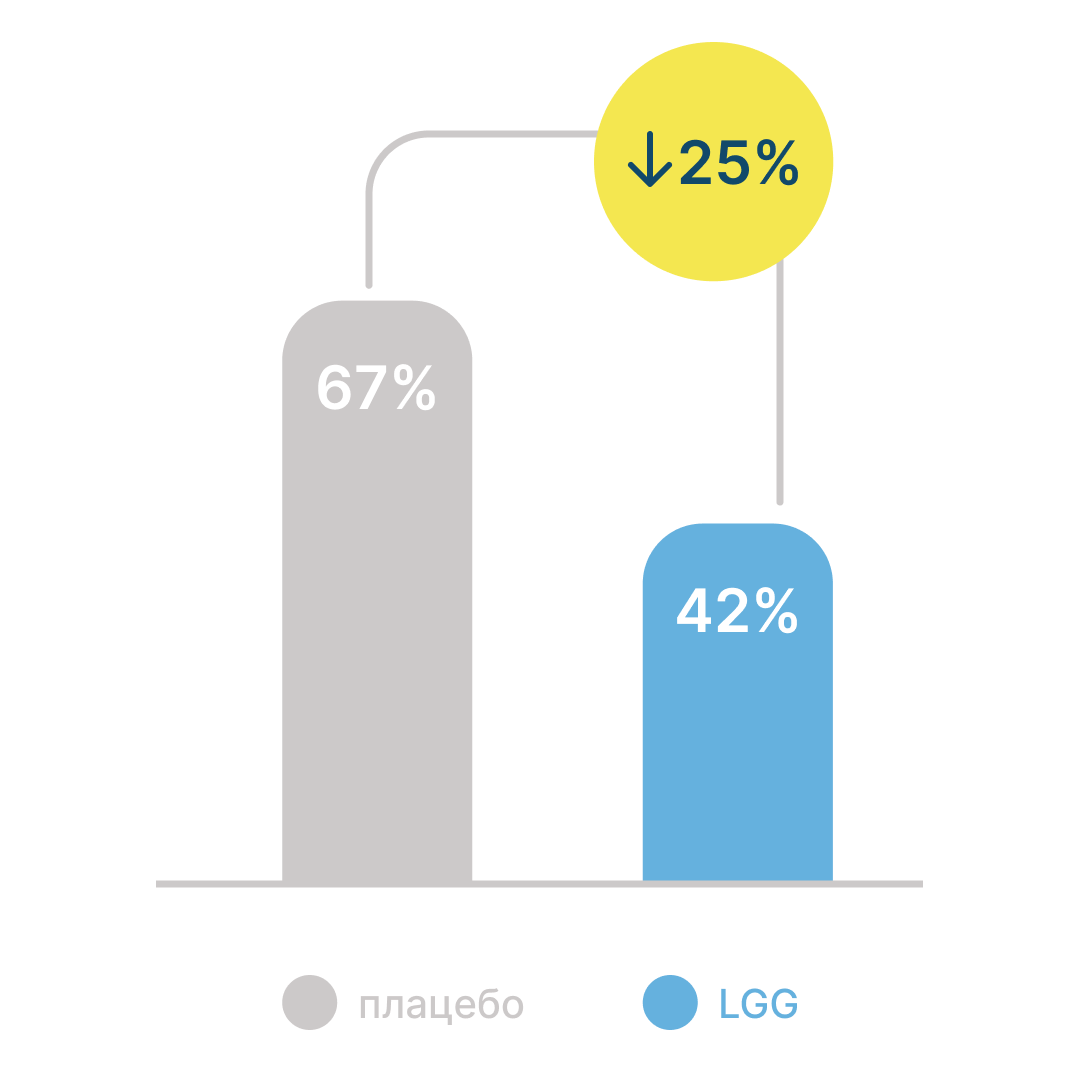
- В группе LGG наблюдалось снижение риска инфекций дыхательных путей на 25%10
- При приеме пробиотика было зафиксировано значительно меньшее количество дней с респираторными симптомами по сравнению с плацебо10.
Эти данные позволили авторам рекомендовать прием LGG как действенное средство для снижения риска инфекций верхних дыхательных путей у детей, посещающих детские сады.
К числу распространенных и хорошо изученных пробиотиков относится и Bifidobacterium longum BB536. Результаты более чем 140 научных публикаций подтвердили способности штамма благотворно влиять на организм хозяина, в том числе стимулировать иммунитет11.
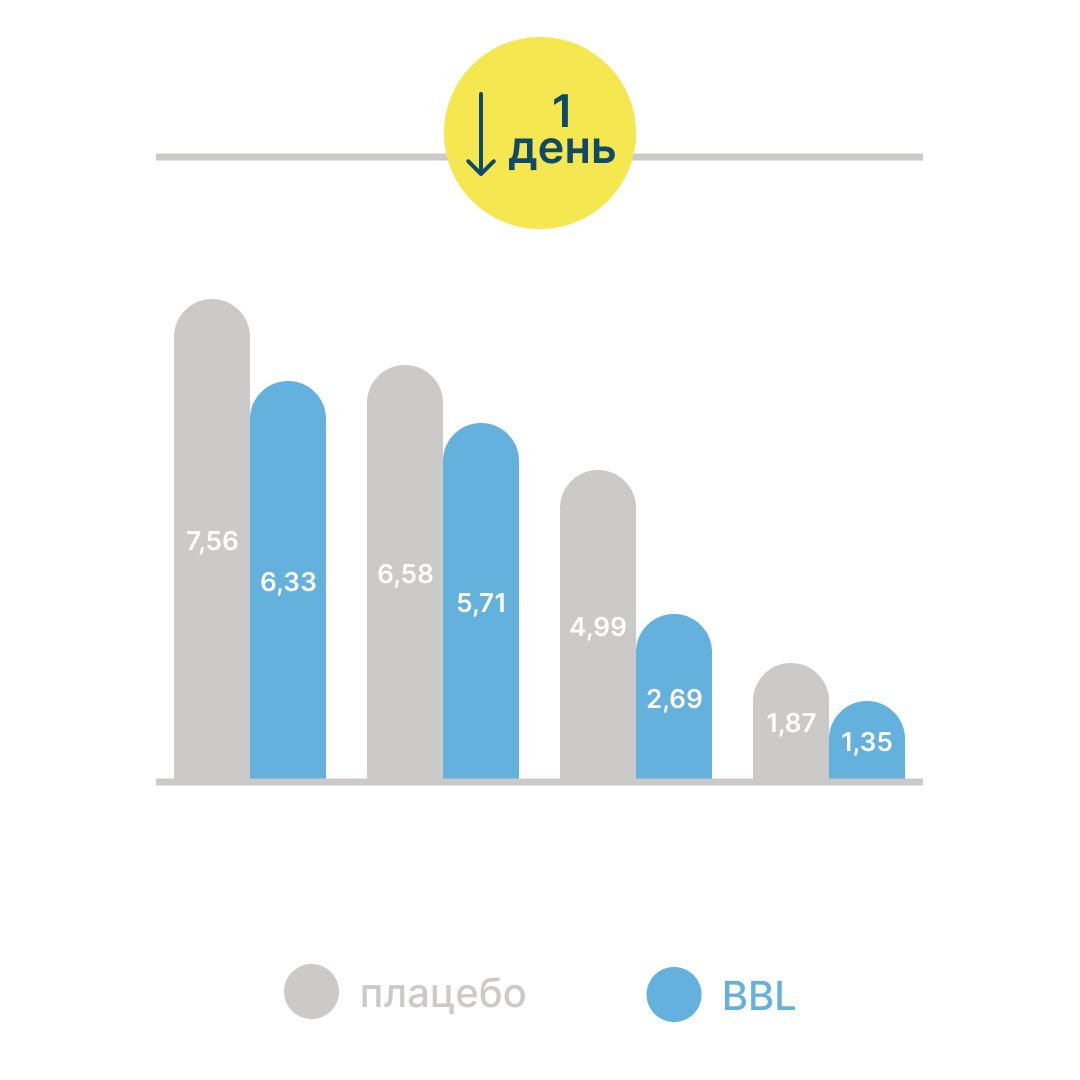
Влияние штамма на заболеваемость респираторными инфекциями у детей было изучено в рандомизированном двойном слепом параллельном плацебо-контролируемом исследовании с участием 520 детей в возрасте 2-6 лет11. У детей, получавших пробиотик, было зафиксировано сокращение продолжительности симптомов ОРВИ по сравнению с группой плацебо:
- боли в горле на 46%
- лихорадки на 27%
- насморка на 15%.
Таким образом, исследование продемонстрировало потенциальные защитные эффекты Bifidobacterium longum BB536 в отношении заболеваний верхних дыхательных путей у детей дошкольного возраста11.
На фоне приема Bifidobacterium longum (BBL) наблюдалось сокращение средней продолжительности симптомов ОРВИ на 1 день (рис.2).
Рисунок 2. Продолжительность симптомов ОРВИ при приеме BBL и плацебо11
Комбинация штаммов Bifidobacterium longum (BBL) 0,5 млрд КОЕ и Lactobacillus rhamnosus (LGG) — 1 млрд КОЕ в форме капель (например, БАД Аципол Малыш) может применяться у детей с первых дней жизни12.
Для детей с 3 лет и взрослых применяют усиленную комбинацию Lactobacillus rhamnosus (LGG) — 5 млрд КОЕ + Bifidobacterium longum (BBL) — 5 млрд КОЕ и цинка13(например, БАД Аципол Форте). Цинк оказывает положительное влияние на состояние кишечной микрофлоры14. За счет влияния на ряд процессов, в частности, клеточный цикл, пролиферацию, дифференцировку клеток и апоптоз цинк участвует в функционировании иммунной системы15.
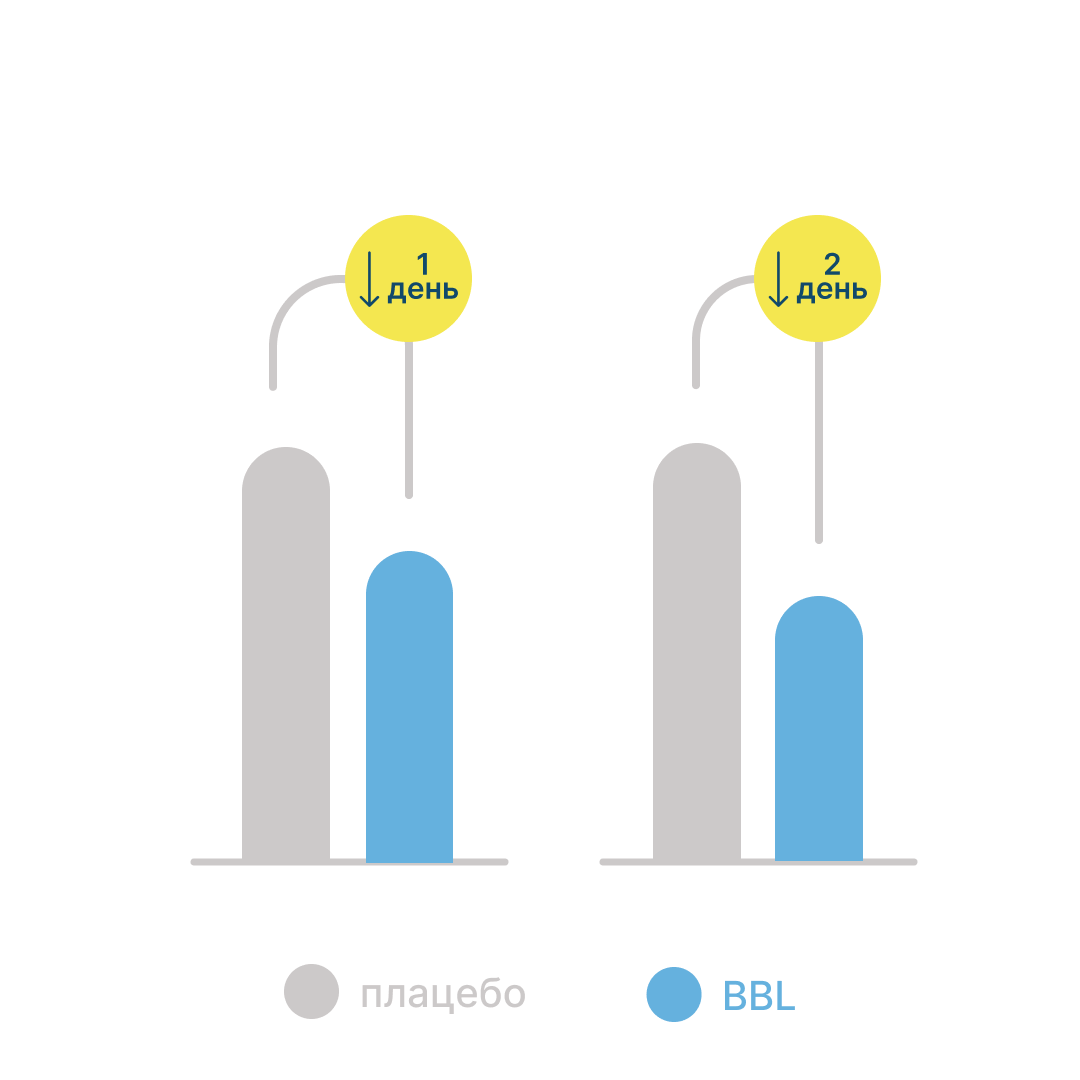
По данным двойного слепого рандомизированного исследования, на фоне приема цинка при ОРВИ наблюдалось более быстрое выздоровление16 (рис. 3).
Рисунок 3. Продолжительность симптомов ОРВИ на фоне приема цинка и плацебо16
Эти свойства обусловливают применение цинка в составе комбинированных формул пробиотиков, направленных на поддержание иммунного статуса, в том числе у часто болеющих детей.
БАД. НЕ ЯВЛЯЕТСЯ ЛЕКАРСТВЕННЫМ СРЕДСТВОМ
ИНФОРМАЦИЯ ДЛЯ СПЕЦИАЛИСТОВ ЗДРАВООХРАНЕНИЯ
РЕКЛАМА АО «ОТИСИФАРМ». erid: 2SDnjd9qnrQ
Список литературы:
- Казумян М. А., Василенок А. В., Теплякова Е. Д. Современный взгляд на проблему" дети с рекуррентными инфекциями"(часто болеющие дети) и их иммунный статус //Медицинский вестник Юга России, 2018. № 3. С. 37-43.
- Самсыгина Г. А. Часто болеющие дети: проблемы патогенеза, диагностики и терапии //Педиатрия. Журнал им. ГН Сперанского, 2005. Т. 84. № 1. С. 68-74.
- Николаева С. В. и др. Пробиотики в комплексной профилактике респираторных инфекций у детей //Лечащий врач, 2021. № 9. С. 22-27.
- Пробиотики и пребиотики. Всемирная гастроэнтеологическая организация (практические рекомендации), 2008. 24 с. http://www.worldgastroenterology.org/assets/downloads/ru/pdf/guidelines/19_probiotics_prebiotics_ru.pdf
- Didari T., Solki S., Mozaffari S., Nikfar S., Abdollahi M. A systematic review of the safety of probiotics // Expert Opin. Drug Saf. 2014; 13: 227-239.
- Sanders M. E., Akkermans L. M. A., Haller D., Hammerman C., Heimbach J., Hörmannsperger G., Huys G., Levy D. D., Lutgendorff F., Mack D., et al. Safety assessment of probiotics for human use //GutMicrobes. 2010; 1: 164-185.
- Tapiovaara L., Lehtoranta L., Poussa T., Mäkivuokko H., Korpela R., Pitkäranta A. Absence of adverse events in healthy individuals using probiotics — Analysis of six randomised studies by one study group //Benef. Microbes. 2016; 7: 161-169
- Venegas D. P., De la Fuente M. K., Landskron G., González M. J., Quera R.,Dijkstra G., Harmsen H. J. M., Faber K. N., Hermoso M. A. Short Chain Fatty Acids (SCFAs)-Mediated Gut Epithelial and Immune Regulation and Its Relevance for Inflammatory Bowel Diseases // Front. Immunol. 2019; 10: 277.
- Оганезова И. А. Кишечная микробиота и иммунитет: иммуномодулирующие эффекты Lactobacillus rhamnosus GG //РМЖ, 2018. Т. 26. № 9. С. 39-44.
- Hojsak I. et al. Lactobacillus GG in the prevention of gastrointestinal and respiratory tract infections in children who attend day care centers: a randomized, double-blind, placebo-controlled trial //Clinical Nutrition. 2010; 29(3): 312-316.
- Lau A. S. Y. et al. Bifidobacterium longum BB536 alleviated upper respiratory illnesses and modulated gut microbiota profiles in Malaysian pre-school children //Beneficial microbes. 2018; 9(1): 61-70.
- Листок-вкладыш Аципол малыш. Свидетельство о гос. Регистрации: № RU.77.99.88.003.E.003651.08.17 от 21.08.2017 г.
- Листок-вкладыш Аципол Форте. Свидетельство о гос. Регистрации: № KZ.16.01.98.003.R.000690.10.22 от 14.10.2022.
- Ва Usama U., Khan M. J., Fatima S. Role of zinc in shaping the gut microbiome; proposed mechanisms and evidence from the literature //J Gastrointest Dig Syst. 2018;8(1):839-860.
- Скальный А. В. и др. Значение коррекции дефицита цинка в практической медицине: обзор //Сеченовский вестник, 2022. Т. 13. № 4. С. 4-17.
- Rerksuppaphol S., Rerksuppaphol L. A randomized controlled trial of zinc supplementation in the treatment of acute respiratory tract infection in Thai children //Pediatric reports. 2019; 11 (2): 7954.
Материалы, подобранные по интересам
Клинические случаи
Ребенок с ОРВИ и аллергостатусом: лечение и профилактика
Патогенез ОРВИ и аллергических заболеваний во многом схож – обе патологии развиваются под влиянием одних и тех же медиаторов воспаления.
Клинические случаи
Внимание, коморбидная патология: ОРВИ и бронхиальная астма
У пациентов с отягощенным аллергологическим анамнезом респираторные инфекции протекают с рядом особенностей, что делает эту категорию больных уязвимыми перед тяжелыми и продолжительными инфекционными процессами.
Практические материалы
Новый взгляд на ротавирусную инфекцию
Ротавирусная инфекция (РВИ) традиционно считается «детской» болезнью, и в какой-то мере это оправдано: уже более 30 лет она признается наиболее распространенной причиной инфекционного гастроэнтерита у детей грудного и раннего возраста.
Клинические исследования
Оценка эффективности препарата Флюковаг
Сегодня одной из наиболее распространенных причин обращения пациенток к гинекологу является вульвовагинальный кандидоз (ВВК).